第二节 土壤中污染物的迁移转化规律
一、重金属元素在土壤中的迁移转化
土壤污染物中重金属元素比较突出。重金属元素不能为土壤微生物所分解,而且可为生物所富集,成为土壤中不断积累的污染物,甚至在土壤中可以转化为毒性更大的甲基化合物。通过食物链,重金属的浓度可以对食物链的某些成员达到有害的水平,最终可以在人体内蓄积达到有害的程度。土壤一旦遭受重金属污染,是较难以彻底消除的,因此,重金属是对人类潜在威胁较大的污染物。研究重金属在土壤中的迁移转化,对评价土壤质量、预断其变化发展趋势和控制重金属污染具有重要的意义。
土壤中重金属污染,不仅要看它的含量,还要看其存在的形态。重金属在土壤中存在的形态不同,其迁移转化和对植物的毒害也不同。
1.重金属在土壤中的一般迁移转化规律
1)胶体的吸附或重金属和胶体的缔合 根据土壤胶体对阳离子吸附的一般原理,胶体对金属离子吸附的能力,同金属离子的性质与胶体的种类有关。
粘土矿物对金属离子吸附的顺序一般是:Cu2+>Pb2+>Ni2+>Co2+>Zn2+>Ba2+>Rb2+>Sr2+>Ca2+>Mg2+>Na+>Li+。其中蒙脱石对重金属吸附的顺序是Pb2+>Cu2+>Ca2+>Ba2+>Mg2+>Hg2+;高岭石是Hg2+>Cu2+>Pb2+;有机胶体对金属的吸附顺序是Pb2+>Cu2+>Cd2+>Zn2+>Ca2+>Hg2+。
溶液的浓度不同,或土壤中有络合剂, 将打乱胶体对阳离子吸附的顺序。
金属离子为土壤胶体所吸附,是其从液相转入固相的重要途径。胶体的吸附,特别是有机胶体的吸附,在很大程度上决定着土壤中重金属的分布和富集。金属元素如被吸附在粘土矿物表面的交换点上,则较易被交换,如被吸持在晶格中,则很难释放。
影响粘土矿物吸附金属离子的因素主要有:粘土矿物的结构和纯度;金属的原子价和离子半径(或水化离子半径);同晶代换形成的自由能。
2)重金属的络合和螯合作用 某些重金属在土壤溶液中往往不是以简单的离子形式存在,而主要以络离子形式存在。据对Hg2+、Cd2+、Pb2+、Zn2+的研究表明,羟基与重金属的络合作用可大大提高重金属氢氧化物的溶解度。
氯络合作用可以提高难溶重金属化合物的溶解度,同时可减弱土壤胶体对重金属的吸附,这对汞尤为突出。
有机螯合物对金属迁移的影响取决于所形成的螯合物是难溶的或易溶的。在腐殖质组成中胡敏酸和金属形成的胡敏酸盐,除一价碱金属盐外,一般是难溶性的。富里酸与金属形成的螯合物则一般为易溶性的。据研究,重金属污染物与腐殖质生成的有机酸作用可生成可溶性稳定的螯合物,能够有效地阻止重金属作为难溶盐而沉淀。腐殖质和Fe、Al、Ti、U、V等金属形成的螯合物易溶于中性、弱酸或弱碱性土壤溶液中,使它们以螯合物形式迁移。当缺乏腐殖质时它们便析为沉淀。
最后,必须指出腐殖质对金属离子的螯合作用与吸附作用是同时存在的。一般认为,当金属离子浓度高时以吸附交换作用为主,而在低浓度时以络合- 螯合作用为主。
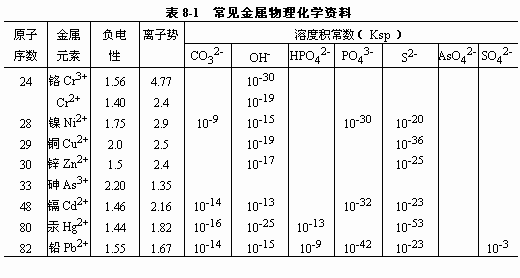
3)重金属的化学沉淀 从表8- 1中溶度积来看,很多有毒重金属是可以形成难溶性化学沉淀的。各种金属在溶液中的稳定性(或是否易生成沉淀)主要与pH和Eh有关。
pH值是影响土壤中重金属迁移转化的重要因素。土壤的pH值大多在5—8之间。酸性土壤的 pH值可能小于4,碱性土壤的pH值则可高达11,在此条件下许多金属元素形成了难溶的氢氧化物。
按金属元素迁移与pH的关系,可以区分为下列几种情况:
(1)在pH<6的活泼元素:Cu、Zn、Ni、Cr、Cd等。
(2)在pH≥7的活泼元素:V、As、Cr6+等。
(3)在广泛pH范围内活泼的元素:Li、Rb、Cs。
金属的原子价愈大,就形成愈难溶解的化合物,其迁移能力也就愈低。阴离子也有同样的规律性。离子半径或原子半径是元素很重要的地球化学特征。因而用离子势也可以推断化学沉淀反应,如Fe2+和 Mn2+的离子势是 2.7和 2.5,在溶液中是稳定的离子,但如氧化为Fe3+,铁将沉淀,其离子势为4.69。因离子半径随价数增加而减少。
