4.2海水中的二氧化碳系统
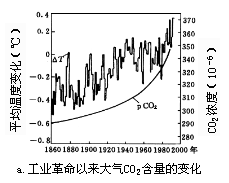
海水是常溶解有大量碳化合物,其中无机碳的主要形式为H2CO3和CO2。溶解CO2可以与大气中的CO2进行交换,这个过程起着调节大气CO2浓度的作用。工业革命以来,由于大量使用矿物燃料,排放大量CO2,使大气CO2浓度上升,形成所谓“温室效应”,影响了全球气候变化(图4—6)。因此近年来对大气与海洋的CO2交换过程十分重视,开展了广泛的国际合作,进行了大量研究工作。CO2海气交换的研究是JGOFS(全球海洋通量研究计划)的重要组成部分。
早期的化学海洋学研究就已经知道海水的二氧化碳系统是维持海水有恒定酸度的重要原因,这是由于在海水中存在下列平衡:
![]()
![]()
这个平衡过程控制着海水的pH,使海水具有缓冲溶液的特性。增加大气的CO2也增加了海水中的无机碳总量,同时增加海水的缓冲容量,引起海水酸度增加,不利于更多的CO2进入海水。
4.2.1海水的pH值
海水的pH值约为8.1,其值变化很小,因此有利于海洋生物的生长;海水的弱碱性有利于海洋生物利用CaCO3组成介壳;海水的CO2含量足以满足海洋生物光合作用的需要,因此海洋成为生命的摇篮。

一般气体在海水中的溶解量与其在大气中的分压成正比,但CO2是个例外。CO2与水有反应,因此提高了它在海水中的浓度。CO2在生物过程中起重要作用,藻类光合作用消耗CO2,产生有机物和氧气。因此,大部分地区的海水表层CO2是不饱和的,深层水由于下沉有机物的分解含有较多的CO2。赤道海域环流和美洲大陆西岸上升流把CO2带入表层水。
海水从大气中吸收CO2的能力很大,而且最初它所能吸收的CO2是现今的几倍。要准确估计海水吸收CO2的能力是较为困难的,因为整个体系处于动态之中。CO2与水生成碳酸,碳酸离解得到碳酸氢根和碳酸根,这是海水中溶解碳的主要化学形式。CO2浓度随深度增加,因为藻类光合作用消耗CO2而在呼吸中放出CO2,另一个原因是CO2的溶解度随压力增加而增加。
天然的碳有三种同位素:12C,13C和14C。其中14C是放射性同位素。大气中的14C有两种来源,一是宇宙射线与大气中的N2发生核反应产生的;另一种是由于核爆炸产生的。14C进入海洋后,随着海水的运动减低浓度,因此可以用来研究CO2的气体交换速率和水团的年龄等。
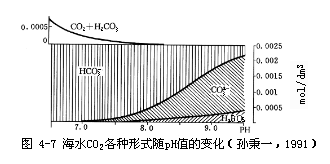
海水中的二氧化碳含量约为2.2mmol/kg。CO2的各种形式随pH的变化
![]()
而CO2+H2CO3含量很低。在CO2+H2CO3中则是以溶解CO2为主,H2CO3更少。常常把CO2+H2CO3称为“游离CO2”,写为CCO2(T)。
一、pH标度
1909年Sorensen首次提出了pH标度,定义为
![]()
这里是使用H+的浓度标度的,在1924年离子活度概念提出后,他又提出一个用活度标度的定义:
![]()
这两种标度之间差一个常数,25℃时,paH=psH+0.027。
二、pH实用标度
但是,实际上单独离子的活度无法测定,为了得到一个确定的值,需要确定一个实用标准,即根据现有的pH标准液(pHs)对比未知溶液的pH
![]()
这里的pHs标准一般采用0.05mol/dm3苯二甲酸氢钾的水溶液在25℃时pH值,即4.00。
三、影响海水pH的因素
海水的pH一般在7.5~8.2的范围变化,主要取决于二氧化碳的平衡。在温度、压力、盐度一定的情况下,海水的pH主要取决于H2CO3各种离解形式的比值。反过来,当海水pH值测定后也可以推算出碳
![]()
![]()
![]()
![]()
就可以计算出pH。在实验室测定海水的pH时,如果温度、压力与现场海水不同,则需要进行校正。
温度校正可用下式
pHt1(现场)=pHt1(测定)+0.0113(t2-t1) (4-14)
由于深度改变引起的压力校正可以通过查表得到。
4.2.2海水的缓冲容量
海水具有一定的缓冲能力,这种缓冲能力主要是受二氧化碳系统控制的。缓冲能力可以用数值表示,称为缓冲容量。定义为使pH变化一个单位所需加入的酸或碱的量:
![]()
海水的pH在6~9之间时缓冲容量最大。大洋水的pH变化主要是由CO2的增加或减少引起的。海水的缓冲容量除与CO2有关外,还与H3BO3有关。由于离子对的影响,海水的缓冲容量比淡水和NaCl溶液都要大。
4.2.3海水的总碱度、碳酸碱度和总二氧化碳
一、海水总碱度
海水的总碱度AT,是由于碳酸根离子、碳酸氢根负离子和硼酸根离子形成的,其单位为摩尔浓度。
定义碱度的依据为:海水是电中性的,可以用滴定的方法测定(下标T表示滴定)。按SI,碱度定义为:用以中和弱酸负离子所需氢离子的物质量除以海水的体积,符号记为A,单位是摩尔每立方分米(mol/dm3)。总碱度可以分为3部分:碳酸盐碱度(CA)、硼酸盐碱度(BA)和过剩碱度(SA)。
碱度方程式表示了溶液中正负离子的电中性:
![]()
过剩碱度SA是除硼酸和碳酸之外的全部弱酸总浓度。硼酸的二、三级离解常数很小,所以硼酸体系对AT的贡献是主要的。在海水中([OH-]-[H+])和SA的值很小,所以方程式(4-16)可以简化,得到
![]()
在缺氧的环境下,硫酸根、铵和磷酸盐很高,SA不能忽略,海水的pH一般在7.8~8.4之间,PCO2在(2.0~13.0)×10-6mol/kg,AT在(2.3~2.6)×10-3mol/kg。
二、海水的碳酸碱度
![]()
碱度贡献而得到。
![]()
![]()
镁等形成离子对的浓度。在大洋海水的酸度下,只有小于1%的碳是以[CO2(aq)]+[H2O3]存在的,而[H2CO3]又只是CO2(aq)的0.2%。
需要指出,碱度是指碳酸根和碳酸氢根浓度之和。它不是pH的度量,也不是海水碱性的度量。了解这一点后就不难理解海水的碱度和酸度有时向同样方向移动:当DIC很高时,海水的酸度和碱度也都很高;当DIC很低时,酸度和碱度也都较低。在巴哈马海岸有碳酸钙的无机沉积,那里的海水盐度很高(>37),海水较浅较暖;水温越高,盐度越大,气体(包括CO2)的
![]()
的沉淀微晶,此时,(AT-DIC)很大。
依大气成分的变化记录和化石燃料燃烧向大气排放的CO2,可以估计人类活动产生的CO2大约50%滞留在大气中,其余部分的70%~80%被海洋吸收,剩下的30%则不得而知。植被量的增加可能是原因之一。
海洋表面与大气一直进行着CO2气体交换。交换的方向取决于温度,以及水相与气相的CO2浓度的差异。因为温度对PCO2影响很大,温度每升高1℃,PCO2增加4%左右。因此赤道地区的PCO2比南北极要大得多。
如果海水表面的CO2浓度低于大气中的浓度,则大气中的CO2可以向海水中输送,这种情况一般在高纬度地区发生;反之,如果PCO2(海)>PCO2(气),则CO2由海水向大气输送。
三、海水的总二氧化碳
海水对CO2的吸收有3个因素:一是海水的静态容量,即达到平衡后海水中的CO2含量增加多少,这是热力学平衡问题;二是动力学问题,即大气-海洋之间CO2交换速度有多快,这取决于CO2的交换速率;三是海水铅直混合速率。
大气中二氧化碳含量的增加,已经成为一个全球关注的重大问题。虽然大气中CO2增加的原因已经较为清楚,但是一直没有采取什么切实行动来减少CO2的排放,原因之一就是寻求替代燃料价格昂贵。所以,如何把已经产生的过剩CO2除去就更令人感兴趣。
在赤道地区、北太平洋和南大洋等海域的表层水中有丰富的硝酸盐、磷酸盐,但是生物量却很低。法国海洋化学家Martin指出,其主要原因是铁的限制。国际上在1992年和1995年曾经进行了IronEX—Ⅰ和IronEX—Ⅱ的实验,证实在大面积海域中添加微量铁盐,可以大大提高藻类的增殖速度,从而吸收更多的大气CO2。海水作为CO2的汇集体,通过“铁施肥”吸收了增加的部分CO2。因此可以预计,这对于减缓海洋全球变暖过程会有较大的影响。
如果铁限制的结论是正确的,在这些海域添加可溶性铁盐,促进初级生产力,就可以吸收掉人类活动产生的1/2~1/3的CO2,足以补救燃烧化石燃料引起的问题。当然,极而言之,也有可能因光合作用持续增长吸收过多的CO2,导致冰期提前到来。
